INFORMATION
(주)이안은 환경중시 기업 가치를 바탕으로 자율적인 환경 경영 시스템을 운영하고 있습니다.
기술자료
음료에서 공정관리의 효율화를 위한 총 가스의 측정
탄산가스 주입시 공기의 영향
앞에서도 언급하였듯이, 탄산음료나 맥주의 탄산 주입은 대부분 제품의 온도와 총압력 측정을 근거로 하여 결정합니다. 청량음료에서 총압력이 탄산만의 압력이라는 가정은 틀린 것입니다. 총압력은 사실은 4 종류 가스 분압입니다 : 탄산 압력 (PCO2), 질소 압력 (PN2), 산소 압력 (PO2) 그리고 물의 증발 압력 (PH2O) 입니다. 엄밀히 말하면:
Ptotal * PCO2 Ptotal = PCO2 + PN2 + PO2 + PH2O
대부분의 압력 / 온도 탄산가스 환산표는 물의 증발압을 (PH2O) 고려합니다. 그러나, 환산표는 공기의 함량인 질소와 산소의 압력은 (PN2+ PO2) 고려하지 않습니다. 공기의 분압은 (PN2 + PO2) 총 압력에 (Ptotal) 영향을 미칩니다. 공기가 총압력에 얼마나 영향을 미치는지는 뒤에서 설명하겠습니다. 보통 탄산 제품의 가스들은 매우 다양합니다. 대략적인 농도는 아래와 같습니다 :
용존 가스
2 to 4 V/V CO2 : ~ 4000 to 8000 ppm
2 to 6 ppm N2
1 to 3 ppm O2
헤드스페이스 가스
92에서 96 % CO2
2에서 6 % N2
0.5에서 2 % O2
0.5에서 1 % water vapor
아래의 보기는 공기의 영향에 따른 탄산 농도의 압력/온도 계산의 오류입니다:
압력/온도에 따른 탄산 측정에서는 38 psig @ 68 oF --> 압력/온도 표에서 --> 3.02 V/V
Ptotal = PCO2 + PN2 + PO2 + PH2O
물의 증발압 = PH2O = 0.36 psi @ 68 oF (20 oC)
만약 용존 산소의 농도가 1 ppm인 경우 (DO2) --> 산소의 분압 (PO2) = 0.36 psi
공기에서의 질소대 산소의 비가 약 4/1이므로
질소/산소의 분압 또한 4/1입니다.
PN2 = 4(PO2) = 4 (0.36) = 1.44 psi
Ptotal = gauge pressure (psig) + absolute pressure (psia)
Ptotal = 38 psi + 14.5 psi = 52.5 psia
Ptotal = 52.5 psi = PCO2 + PO2 + PN2 + PH2O
공기의 분압 = Pair
Pair = PO2 + PN2 = 0.36 psi + 1.44 psi = 1.8 psi
실제 탄산만의 압력은 = PCO2
PCO2 = Ptotal - PN2 - PO2 - PH2O
PCO2 = 52.5 psi - 1.44 psi - 0.36 psi - 0.36 psi = 50.3 psi
PCO2 = 50.3 psi --> from CO2 solubility table -->
실제 탄산 (CO2 ) 농도 = 2.91 V/V CO2
공기/총압력 오류 = air pressure / total pressure
오류 = Pair / Ptotal = 1.8 psi / 52.5 psi = 3.4 %
압력/온도 환산표에 의한 탄산의 농도 = 3.02 V/V
실제 탄산 농도는 2.91 V/V 입니다.
공기가 있는 경우 탄산의 농도 오류는 0.1 V/V 입니다.
따라서 압력/온도 탄산 측정은 탄산음료에 있는 공기에 의한 오류가 20 oC 에서:
용존 산소가 (DO2 )1 ppm 이면 약 3%의 오류
- 실제 탄산의 농도는 약 0.1 V/V 낮게 지시
용존 산소가 (DO2 )2 ppm 이면 약 6%의 오류
- 실제 탄산의 농도는 약 0.2 V/V 낮게 지시
나타날 수 있는 오류를 하나 더 예를 들면, 품질 보증 부서에서 탄산소다 캔 제품 2 개를 각각 압력과 온도를 읽습니다(44 psig @ 20 oC). QA 부서는 두개가 같다고 말 합니다 …
Can # 1 --> 44 psig @ 20 oC --> 3.50 V/V (on P/T water table) Can # 2 --> 44 psig @ 20 oC --> 3.61 V/V (on P/T soda table)
두개의 서로 다른 표를 사용은 탄산 농도를 다르게 하는 중요한 원인이 됩니다. 서로 다른 표의 편차 가능성은 제품의 총압력이 실제로는 몇 개 가스의 분압이기 때문입니다. 이 제품이 각각의 총 압력이20 oC에서 44 psig일지라도 실제 탄산의 농도는 다릅니다. 이론적으론 총압력이 같다 할지라도 (44 psig @ 20 oC) 캔 제품의 용존 가스의 농도는:
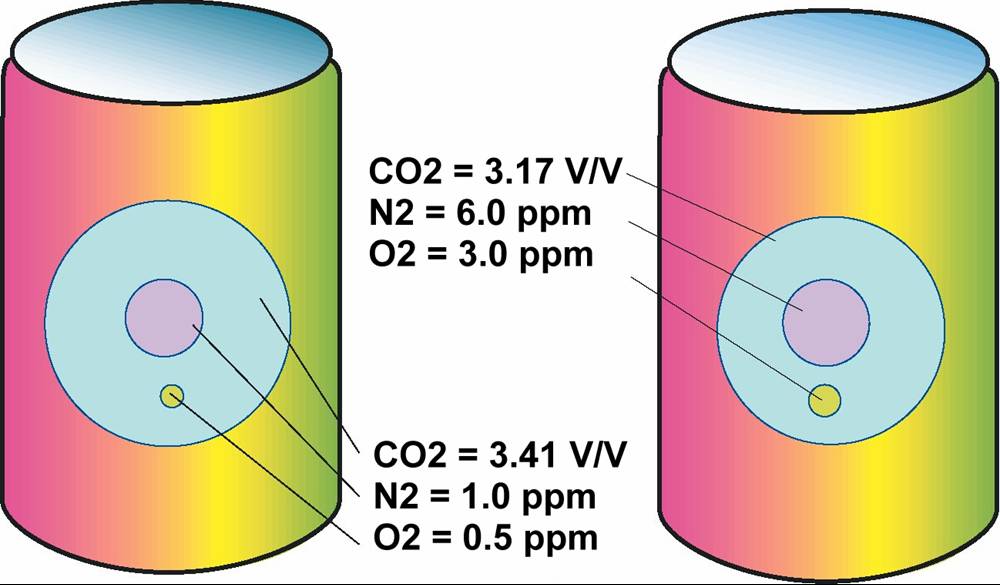
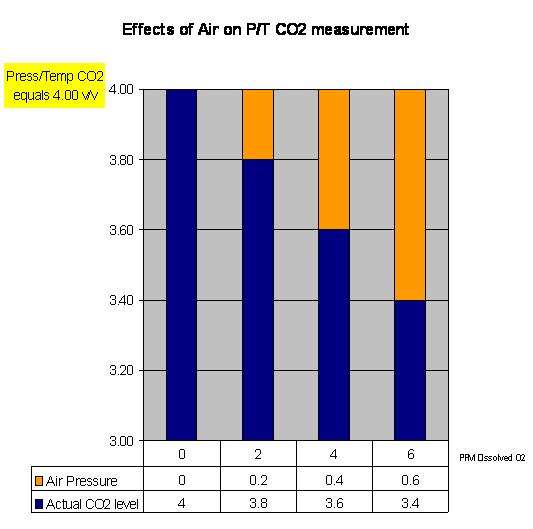
압력/온도 환산표의 편차는 탄산 농도의 결과치를 다르게 하는 원인입니다. 총 압력이 똑 같을 지라도 공기의 분압에 따라서 실제 탄산의 농도는 다를 수 있습니다. 아래의 그래프는 온도/압력 탄산농도와 실제 탄산 농도에 공기가 미치는 영향을(용존 산소의 비례와 연계하여) 나타냅니다:
아래의 데이터는 탄산음료의 on-line 가스 측정 시스템에서 수치입니다. 이 실례는 공정상에서 탈기 장치의 효력이 서서히 떨어지고 있을 때입니다. 용존 산소와 연계하여: 압력/온도 탄산 농도와 실제 탄산의 농도 비교 값입니다.
Plus |
Pressure / |
True CO2 |
DO2 |
0.33 |
3.00 |
2.97 |
0.28 |
0.67 |
3.00 |
2.97 |
0.27 |
1.00 |
2.98 |
2.95 |
0.27 |
1.33 |
2.99 |
2.96 |
0.27 |
1.67 |
2.98 |
2.95 |
0.28 |
2.00 |
3.00 |
2.97 |
0.34 |
2.33 |
3.00 |
2.96 |
0.40 |
2.67 |
3.01 |
2.96 |
0.54 |
3.00 |
3.01 |
2.94 |
0.69 |
3.33 |
3.02 |
2.94 |
0.79 |
3.67 |
3.02 |
2.93 |
0.95 |
4.00 |
2.99 |
2.90 |
0.94 |
4.33 |
3.00 |
2.91 |
0.95 |
4.67 |
3.03 |
2.92 |
1.09 |
5.00 |
3.00 |
2.89 |
1.08 |
5.33 |
2.99 |
2.88 |
1.09 |
5.67 |
3.00 |
2.87 |
1.28 |
6.00 |
3.01 |
2.84 |
1.75 |
6.33 |
3.01 |
2.82 |
1.87 |
6.67 |
3.03 |
2.77 |
2.61 |
7.00 |
3.04 |
2.77 |
2.74 |
7.33 |
3.03 |
2.75 |
2.84 |
7.67 |
3.02 |
2.74 |
2.84 |
8.00 |
3.02 |
2.72 |
3.05 |
8.33 |
3.01 |
2.70 |
3.15 |
8.67 |
3.02 |
2.69 |
3.26 |
9.00 |
3.01 |
2.67 |
3.39 |
앞에서의 데이터를 시간에 따른 그래프 상으로 표시하면 아래와 같습1니다.
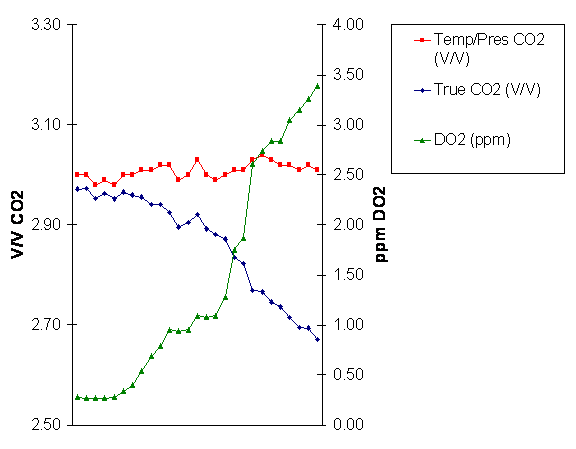
그래프 상에서 탈기 장치의 고장으로 인하여 용존 산소의 농도가 증가하는 것을 쉽게 알 수 있습니다. 산소 분압의 증가는 실제 탄산 농도의 ( 탄산의 분압 ) 순차적인 감소의 원인이 됩니다. 그러나 온도 / 압력 탄산 농도는 거의 변함이 없습니다. 이것은 총 압력이 (P CO2 + P N2 + P O2) 변하지 않기 때문입니다. 맥주의 탄산 주입에서 산소와 질소의 영향은 탄산음료보다 보통은 적습니다 . 이것은 사실 맥주는 일반적으로 총압력이 산소와 질소의 분압으로부터 받는 영향이 적기 때문입니다. 또한 맥주에서는 산소와 질소의 비율이 공기의 비율과 다릅니다. 산소와 질소의 비교에 관한 자세한 사항은 다음 장에서 설명하기로 합니다.
